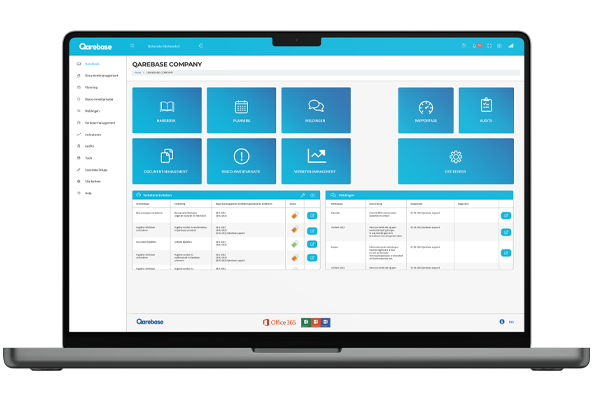
- Waarom Qarebase
- Voor wie
BEDRIJFSGROOTTE
Compacte teams
Eenvoudig op orde
Het hele MKB
Beheer voor de hele organisatie
De grootste organisaties
Voor alle locaties en afdelingen
Franchise en groep
Controle binnen de groep
BEDRIJFSTYPE
Dienstverlening
Zorg, logistiek, financieel, IT
Productie
Bouw, infra, chemie, installatie
Groothandel en retail
E-commerce, franchise, export
Overig
Onderwijs, facilitair, overheid
VOOR ADVIESBUREAUS
Adviseurs uit elke sector
Gebruik de beheer versie van Qarebase om jouw klanten nog beter te adviseren in hun certificeringen. Ga effectiever om met je tijd en laat jouw adviseurs nog sneller en makkelijker samenwerken met de klant.
- Diensten
- Support
- Over ons
OVER ONS
De mensen van Qarebase Company hebben aantoonbaar de competenties om jou op een laagdrempelige en praktische manier te helpen met kwaliteits management.
NIEUWSBERICHTEN
Bekijk onze nieuwsberichten en lees updates over Qarebase, wat ons bezighoud en ontdek relevante artikelen die voor jouw van belang kunnen zijn.
VACATURES
Werken bij Qarebase Company! Ben jij op zoek naar een baan in een dynamische omgeving? Dan zijn we op zoek naar jou. Bekijk onze huidige vacatures hier.
- Contact